1 Introducción
1.1 Presentación del fenómeno de la
corrosión
1.1.1 La corrosión: un fenómeno de
importancia económica mayor
El fenómeno de la corrosión de los
metales induce deterioro de numerosas estructuras industriales en los
dominios de transportes, química, construcción, agua,
industria general que se estiman al 3,5% del producto interior bruto de
todos los países.
(report of the comittee on corrosion and
protection - presidido por T.P.Hoar- dept.of trade and industry. HMSO.
Londres 1971).
Siendo la corrosión una vuelta a un estado
más estable del metal, aparece como inevitable. No obstante, se
puede ralentizar e incluso evitar los fenómenos de
corrosión mediante reglas de diseño y tratamientos
adecuados como anodizado, protección anódica, capas
protectoras, pasivación y otros. Si unos métodos
adecuados fuesen sistemáticamente utilizados para proteger a los
metales, resultará en un ahorro del 22.7% (ibid.). De esto se
destaca la importancia de conocer lo mejor posible el comportamiento de
los materiales de uso industrial frente a la corrosión, que es
el tema de este proyecto, aplicado a ciertas aleaciones de aluminio.
1.1.2 Definición de la corrosión
La corrosión de metales es el proceso por el
cual pasan del estado metálico al estado combinado, es decir, lo
inverso de la metalurgia extractiva. En tal proceso los átomos
pierden uno o varios electrones lo que aumenta su número de
oxidación.
1.1.3 Clasificación
Hay muchas maneras de clasificar a los
procesos de corrosión, basadas en los aspectos más
destacados de reacciones particulares. Una distinción frecuente
es la que se hace entre procesos de corrosión por vía
electroquímica y por vía seca, según tenga lugar
en presencia de un electrolito liquido o no. También se puede
preferir clasificar algún fenómeno según el medio
oxidante, la morfología del ataque u otros parámetros
adaptados.
Corrosión por vía seca
Se trata de un proceso de alta temperatura,
extremamente destructor, por la alta energía calorífica
del ambiente, que consiste en la reacción directa del metal con
los gases del ambiente (Oxigeno). La alta temperatura (mayor de cien
grados) conduce muy a menudo a reacciones de volatilización de
los productos de corrosión, dejando así la superficie
metálica siempre descubierta y disponible para el proceso de
corrosión.
Sin embargo, este fenómeno queda limitado por
las temperaturas a las que ocurre a ciertas aplicaciones tipo horno que
no son las condiciones más frecuentes de uso de materiales
metálicos.
Corrosión por vía húmeda
Se trata de la manera más habitual que tiene
un metal de corroerse. Interviene en la reacción un medio
húmedo, electrolítico, que asegura el transporte de
cargas entre ánodo y cátodo. No hace falta que el metal
sea sumergido en líquido para tener este tipo de
corrosión puesto que la capa de humedad debido a la
condensación atmosférica basta para hacer de electrolito.
Corrosión galvánica
La corrosión galvánica es la que ocurre
cuando dos metales distintos están juntos. La diferencia entre
la estabilidad termodinámica de los dos metales conduce a la
oxidación más importante del menos estable y a la
protección relativa del más noble.
La necesidad de juntar materiales distintos para un
gran número de aplicaciones lleva consigo la desventaja de
incrementar corrosión galvánica.
Corrosión uniforme y corrosión
localizada
Siendo la corrosión un fenómeno
inevitable, interesa pues él poder prever cuando tal pieza
será fragilizada e incapaz de asumir su función
mecánica.
En corrosión uniforme, toda la superficie
está atacada de igual manera, lo que permite, midiendo el
espesor a intervalos de tiempo, tener una visión de la
evolución hacia el fallo de la pieza. Permite entonces disparar
la alarma antes de la rotura.
Al contrario, en corrosión localizada, la
degradación se concentra en puntos precisos, donde suele ser
mucho más rápida. Es entonces difícil vigilar el
estado mecánico de la pieza en cada uno de estos puntos de
corrosión pudiendo dar lugar a iniciación y
propagación de grieta y rotura.
La previsión del fallo es mucho más
fácil en los casos de corrosión uniforme, donde la
degradación está directamente relacionada con el espesor,
que en corrosión localizada, donde los puntos de
corrosión progresan más rápidamente hacia el
interior de la pieza, fragilizándola.
La corrosión localizada es particularmente
importante en aquellos metales que desarrollan una capa pasiva en
superficie. La rotura de esta capa se produce en puntos particulares
que dan lugar a corrosión localizada. Esta está tanto
más fuerte cuando lo demás sigue protegido. Esta rotura
es favorecida por ciertos medios corrosivos.
Una técnica utilizada para estudiar el
comportamiento de metales que se corroen localmente es la
espectroscopia de impedancia electroquímica o Electrochemical
Impedance Spectroscopy (EIS). En ciertos casos, permite tener una idea
de la velocidad de crecimiento de la picadura.
El aluminio tiene particular tendencia a
corrosión localizada, sea en resquicios o picaduras, por tener
una capa pasiva que se desestabiliza en presencia de iones cloruro (y
otros de la misma familia -Halogenuros).
1.1.4 Termodinámica de la corrosión
La corrosión es el proceso por el cual un
metal en estado metálico vuelve al estado combinado,
termodinámicamente más estable. El metal reacciona
según la ecuación Me=Men+ +ne-.
El sentido en el que se desarrolla la
reacción de corrosión está determinado por la
energía libre de Gibbs. El sistema metal/medio reacciona en el
sentido tal que disminuya su energía libre.
Sin embargo, la velocidad de reacción no
depende solo de las características termodinámicas del
material sino también del medio y de las condiciones en las
cuales se produce la reacción.
Por lo tanto, y como nos lo enseña la
experiencia cotidiana, los metales no se oxidan siempre, aunque el
estado combinado sea el más estable.
A la tendencia termodinámica de cada
reacción a producirse se asocia el cambio de la energía
libre de Gibbs. Está última se relaciona con el potencial
de Nernst en las reacciones electroquímicas.
En la reacción Me=Men+ +ne-,
el cambio de energía libre vale (G=-nFE donde F vale 96500C,
cantidad de electricidad correspondiente a un mol de electrones, n el
número de electrones implicados en la reacción, E el
potencial al que tiene lugar el proceso.
Por otra parte, el cambio de la energía libre
no es el mismo a cada temperatura. Varía también
según las actividades de los reactantes. Tenemos así: (G=
(G0+RTLnK, siendo (G0 el cambio de energía libre de la
reacción en condiciones normales de temperatura y
presión. R la constante de los gases perfectos. T la temperatura
en Kelvin.
Se reconoce ahora la ecuación de Nernst,
cambiando (G en la segunda igualdad por su valor en la primer
ecuación. Midiendo el potencial E se accede pues a la tendencia
termodinámica de la reacción.
1.1.5 Cinética de la reacción
Estas consideraciones termodinámicas permiten
predecir cual será el estado más estable del metal en un
cierto medio, midiendo su potencial.
Sin embargo, existen otras limitaciones de la
corrosión, relativas a la cinética de la reacción.
Por ejemplo, el aluminio tiene un estado combinado mucho más
estable que el estado metálico. No obstante, se utiliza
justamente por su alta resistencia a la corrosión. Eso es porque
la alúmina, que es el producto de corrosión que
corresponde al aluminio en la mayoría de los casos, forma una
capa aislante que protege la superficie del metal.
Para que se produzca la reacción de
corrosión, hace falta superar una cierta energía de
activación. Esta energía se debe, a la presencia de
moléculas de agua fuertemente ligadas a la superficie
metálica así como a los iones presentes en el electrolito.
ASM Metals Handbook
Plano de Helmholtz
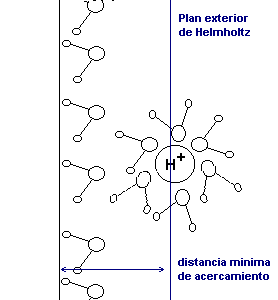 Los
iones oxidantes se hidratan y se rodean de una capa de moléculas
de
agua con enlaces fuertes. Al acercarse de la superficie del metal,
estas moléculas de agua, como las que están adsorbidas en
la
superficie, impiden en contacto entre los iones oxidantes y el metal en
estado metálico. La energía necesaria para romper los
enlaces con las
moléculas de está capa constituye la energía de
activación. La
existencia de esta barrera de energía puede ralentizar
considerablemente el proceso de corrosión. El plano de Helmholtz
es el
plano paralelo a la superficie de la probeta y alejado de la distancia
mínima de acercamiento de los iones sin que tengan que
deshacerse de su
capa de hidratación.
Los
iones oxidantes se hidratan y se rodean de una capa de moléculas
de
agua con enlaces fuertes. Al acercarse de la superficie del metal,
estas moléculas de agua, como las que están adsorbidas en
la
superficie, impiden en contacto entre los iones oxidantes y el metal en
estado metálico. La energía necesaria para romper los
enlaces con las
moléculas de está capa constituye la energía de
activación. La
existencia de esta barrera de energía puede ralentizar
considerablemente el proceso de corrosión. El plano de Helmholtz
es el
plano paralelo a la superficie de la probeta y alejado de la distancia
mínima de acercamiento de los iones sin que tengan que
deshacerse de su
capa de hidratación.
1.1.6 Corrosión de aluminio
El aluminio es un metal interesante desde el punto de
vista de sus propiedades de resistencia a la corrosión. En aire,
forma una película de alúmina que lo protege de una
oxidación más importante. Esta capa se forma muy
rápidamente. Es un ejemplo de la importancia que tiene la
cinética de reacción en la evaluación del
comportamiento de un metal, puesto que el aluminio tiene gran tendencia
termodinámica a corroerse - tiene un potencial muy negativo con
respeto al hidrogeno- pero su capa de óxidos entorpece la
reacción hasta que parezca parada.
La existencia de esta capa pasiva está sujeta
a limitaciones. En presencia de ciertos atacantes, la capa pasiva se
agujerea, dando lugar a la corrosión localizada. Este tipo de
corrosión es mucho más perjudicial que la
corrosión generalizada porque, por su naturaleza no uniforme,
impide hacer previsiones en cuanto al tiempo de vida de la pieza. Los
medios que contienen iones Cl- son particularmente dañinos, pero
el aluminio también está sujeto a la corrosión
atmosférica, corrosión intergranular,
fragilización por hidrogeno, corrosión por
exfoliación, corrosión filiforme, a formas complejas de
corrosión de conductos enterrados aunque tenga buen
comportamiento en agua pura, lo que no es el caso en ambientes salinos.
Corrosión atmosférica
En la mayoría de los casos, la
corrosión atmosférica se manifiesta por picaduras anchas
pero poco profundas.
Los parámetros más representativos son
los cambios en resistencia a tracción y la profundidad de las
picaduras.
La velocidad de corrosión decrece con el
tiempo. Se ha comprobado así que velocidades del 0,1
mm/año podían pasar al 0,003mm/año, esto en un
ensayo llevado a cabo en borde de mar.
ASTM procedió a ensayos de varios
años en condiciones rurales, industriales o salinas que han
resultado en clasificaciones de materiales. El aluminio 6061 T6 por
ejemplo tiene velocidad de corrosión de 422nm/año durante
ensayos de siete años - acabado en 1958-en Newrak
(New-Jersey).La profundidad máxima de ataque en siete
años era de 98 (m, siendo la perdida de resistencia a
tracción del 0,7%.
ASM Aluminum speciality Handbook,Edª DAVIS
and Co, 1993
Corrosión filiforme
Afecta a aleaciones cubiertas de una capa fina de
material protector orgánico. Tiene la apariencia de una
serpiente, saliendo de un defecto en la capa protectora. Consiste en
una reacción de corrosión por aireación
diferencial que se desarrolla debajo de la capa protectora. El aumento
volumétrico provocado por la ionización del metal base
provoca el levantamiento y agrietamiento de la capa protectora. Los
productos de corrosión viajan de la cabeza, donde tiene lugar el
proceso de ataque, a la cola, punto de partida de la serpiente,
hidratándose progresivamente.
Corrosión intergranular
Es de gran importancia en aleaciones fuertemente
aleados donde se asocia a corrosión bajo tensión. Se
caracteriza mediante unos ensayos estandarizados, como el ASTM G67. El
aluminio 6061 no es muy sensible a este tipo de corrosión.
Fragilización por hidrogeno
La exposición de aluminio a medios que
contienen hidrógeno en medio húmedo conduce a
fragilización y rotura. La mayoría de los casos
estudiados son relativos a aleaciones del grupo 7xxx.
Corrosión por exfoliación
Consiste en delaminación de capas sin corroer
por corrosión de una capa subyacente. Ocurre principalmente en
productos con una destacada anisotropía. El ejemplo
clásico consiste en las aleaciones MMC con fibras de grafito.
Las aleaciones más susceptibles son los 2xxx, 7xxx y 5xxx,
aunque las 6xxx con refuerzos de fibras continuas también
presentan este problema. El ensayo ASM G85 describe ensayos de niebla
salina ácida que permiten discriminar varias aleaciones frente a
este tipo de corrosión.
Conductos enterrados
El aluminio es utilizado como material de
fabricación de tubos y conductos. Debido a la gran variabilidad
de las propiedades de los suelos en cuanto a pH, conductividad,
composición, humedad o microorganismos, las formas de
corrosión son también muy variadas. Sin embargo, se ha
determinado que la presencia de capas protectoras (pinturas) aislantes
y protección catódica mejoran sensiblemente la
resistencia del aluminio.
Corrosión en aguas salinas
Como consecuencia de la desestabilización de
la capa protectora de alúmina por los iones Cl- presentes en
agua de mar, son medios muy agresivos para las aleaciones de aluminio.
Los que mejor resisten son los 5xxx y 3xxx. Los 6xxx
presentan problemas de corrosión un poco más graves.
Para los 5xxx, la velocidad de corrosión llega
a ser del orden de 3 a 6 (m por año. En todos los casos se trata
de corrosión localizada, de tipo picadura o resquicios. La
velocidad tiende a aumentar cuando baja la temperatura, el pH o la
velocidad del flujo y cuando aumenta la cantidad de oxígeno
disuelto.
1.1.7 Corrosión del aluminio 7015
El aluminio 7015 constituye la matriz de una parte de
las probetas que vamos a ensayar. Por eso detallaremos algo más
su comportamiento frente a la corrosión.
Hay pocos datos sobre estas aleaciones en la
bibliografía. Las informaciones encontradas sobre la
corrosión de este tipo de aleaciones se enfocan generalmente en
otras aleaciones 7xxx.
El Al 7015 tiene como elementos de aleación un
4,6 a 5,2% del peso en zinc, 1,3 a 2,1% de Magnesio, hierro, silicio,
cromo, cobre y manganeso. Las aleaciones de aluminio con zinc son
endurecibles por precipitación y tienen mejor resistencia que la
mayoría de los 6xxx. Se considera a menudo un
sobre-envejecimiento para conseguir un mejor compromiso entre las
propiedades mecánicas y de resistencia a corrosión.
ASM Aluminum Speciality Handbook
1.1.8 Corrosión del aluminio 6061
Junto al Aluminio 7015, el aluminio 6061 constituye
la matriz de una parte de las probetas que vamos a ensayar. Por eso
detallaremos algo más su comportamiento frente a la
corrosión.
 El potencial del aluminio 6061
en sus dos estados de temple T4 y T6 es de -0.80V para el primero y
-0.83V para el segundo, o sea, bastante reactivo.
El potencial del aluminio 6061
en sus dos estados de temple T4 y T6 es de -0.80V para el primero y
-0.83V para el segundo, o sea, bastante reactivo.
Tal metal forma una película de óxidos
en la mayoría de los medios. Esta película lo protege
contra una corrosión más aguda. El espesor de esta capa
es de 1nm cuando acaba de formarse al aire libre en una superficie
recién pulida. Se compone de dos capas, la mas próxima al
metal es compacta, amorfa, de espesor determinada por la temperatura.
Por encima de ella hay otra capa mas gruesa y más porosa formada
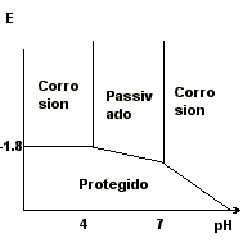
por óxido hidratado.
Estas capas son bastante gruesas en medios poco
agresivos, hasta 200nm.
La estabilidad de esta capa de óxidos se puede
predecir mediante análisis del diagrama de Pourbaix.
Como la corrosión del aluminio 6061 es
habitualmente
por picaduras, se da particular importancia al potencial de picadura
como indicador de su capacidad a resistir a los ataques.
Cuando
más Cl- haya, más negativo el potencial de Epit con
variaciones entre
-0.35V para [Cl-]=0.05mol.l-1 hasta -0.50V para [Cl-]=1.0 mol.l-1 para
el H99.
ASM Aluminum speciality Handbook, Edª DAVIS
and Co, 1993.ASTM.
1.2 Ensayos de resistencia a corrosión
1.2.1 Introducción
La voluntad de organizar metales según sus
propiedades frente a corrosión ha conducido a la
elaboración de ensayos estandarizados de resistencia. Estos
ensayos están diseñados para probar los puntos más
débiles de cada metal. En el caso del aluminio, se ensaya a
menudo su resistencia en medios salinos. Los ensayos estandarizados de
aluminio se reparten en dos grandes categorías, que han tenido
mucho éxito: los ensayos de inmersión, y los ensayos
electroquímicos. Los ensayos de inmersión consisten en
poner el metal en el medio salino estudiado y, después de
algún tiempo, considerar el aspecto macro y micrográfico,
o ensayar propiedades mecánicas de interés. Los ensayos
electroquímicos permiten tener un acceso al mismo mecanismo de
corrosión, puesto que son los efectos eléctricos a base
de esta reacción que se miden directamente.
Una diferencia interesante a la hora de representar
los resultados es que los ensayos de inmersión son generalmente
acelerados, es decir, que el medio de inmersión es más
agresivo que el medio donde es habitualmente utilizado el metal
mientras que los ensayos electroquímicos son muchos más
sensibles y permiten probar el metal en el mismo medio en donde se
utiliza. Algunos ensayos electroquímicos son ahora
estandarizados, pero la mayoría de los ensayos estándar
son ensayos de inmersión. Por ejemplo, el ensayo de niebla
salina permite ver la resistencia de un metal a proyecciones de agua de
mar.
1.2.2 Ensayo de niebla salina ácida
Este ensayo se recoge bajo denominación ASTM
G85. Consiste en exponer probetas a gotas de agua con 5% NaCl y pH=3,
determinado por ácido acético a 50ºC. En el ensayo
de niebla, se mantiene la probeta dentro de una niebla salina. Se
observa el tiempo de aparición de picaduras.
1.2.3 Ensayos de inmersión y secado
Estos ensayos recrean las condiciones de metales
cubiertos temporalmente por un liquido agresivo, para uso en cisternas
o en borde de mar. A cada ciclo se deposita una capa seca del agente
agresivo en superficie. La agresividad de las capas superficiales
aumenta entonces y llega a ser mucho más alta que en el seno de
la solución agresiva.
Este ensayo está especificado en ASTM G44. Las
probetas están sumergidas 10 minutos y dejadas a secar 50
minutos. Se recomienda una especial atención a la hora de
diseñar las condiciones del secado que deben ser las más
reproducibles posibles para permitir comparaciones. El ensayo sigue 24h
al día durante 10 a 90 días. Las probetas se estudian
macro y micrográficamente según las especificaciones del
ensayo.
Hack and Scully Corrosion vol 42 nº2 1986
p79.
1.2.4 Ensayo de corrosión por
exfoliación
Este ensayo ASTM G34 consiste en sumergir una probeta
en 4mol.l-1 NaCl, 0,5 mol.l-1 KNO3, 0,1 mol.l-1 HNO3 a 25ºC. Este
ensayo acelerado puede ser demasiado agresivo para ciertas aleaciones
recientes y deformar los resultados obtenidos en tal caso.
1.2.5 Ensayos electroquímicos
Fenómenos como el descrito en el
párrafo anterior de deformación de resultados han
conducido al desarrollo de ensayos electroquímicos menos
perturbadores del mecanismo de corrosión.
Determinación del potencial de picaduras
El potencial de picadura marca la tendencia
termodinámica de un material a corroerse en forma de picaduras.
La idea de jerarquizar los materiales según su potencial de
picadura apareció rápidamente. Esta técnica
necesita un barrido de potencial en corriente continua, midiendo cada
vez la corriente de equilibrio para un cierto potencial. Resulta en
curvas de polarización que presentan una zona de
pasivación y su cambio a una zona de picaduras. Sin embargo,
este método parece menos satisfactorio que lo esperado. Se
encontró así que la extensión de las picaduras era
mayor en aleaciones con potencial de picadura mas alto, que en
teoría tienen mejor comportamiento.
Mansfeld "Detection and Monitoring of Localized
Corrosion by EIS", Corrosion 92 p229, NACE.
La norma ASTM G61 describe la técnica de
barrido potenciodinámico utilizada para determinar el potencial
de corrosión Ecorr, el de picadura Ep y el de
repasivación Erp. Esta norma está originalmente
contemplada para aleaciones de hierro y níquel.
Ensayos EIS Electrochemical Impedance Spectroscopy
Este método consiste en registrar las
respuestas en frecuencia de una probeta de aluminio sometida a un
potencial de poca amplitud y de frecuencia variable en el medio que nos
interesa. Los datos colectados son representados en diagramas de
Nyquist o de Bode para permitir la determinación de un circuito
equivalente al circuito electroquímico que constituye la
probeta. En condiciones estables -ver el párrafo "limitaciones
de la técnica EIS"- este circuito es representativo del
mecanismo de corrosión activo. La presencia o no de una
impedancia de Warburg indica la existencia de corrosión
localizada. Efectuando varias veces a intervalos de tiempo definidos
tales medidas, se puede hallar una estimación de la velocidad de
corrosión en ciertos medios particulares. Haruyama ha definido
un método de ensayo simplificado, que necesita solo dos medidas
a dos frecuencias distintas, y que permite la determinación de
la resistencia de polarización, característica de los
procesos de corrosión simples.
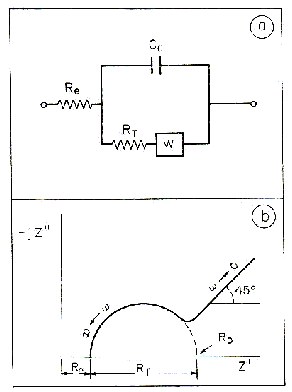
En la figura (a), el elemento marcado W es una
impedancia de Warburg que provoca la aparición de la rama
ascendente a 45º en la figura (b).
Tsuru and Haruyama, Boshoku Gijustu, (Corr. Eng.)
Vol. 27, p573 (1978).
El método de estudio EIS se presenta
detalladamente a continuación.
1.3 Ensayos EIS Electrochemical Impedance
Spectroscopy
1.3.1 Introducción
El método EIS es una técnica
recién desarrollada que permite un acceso más
cómodo a los fenómenos electroquímicos
característicos de la probeta. Este técnica utiliza
corrientes alternas de baja amplitud para conseguir el espectro en
frecuencia de la probeta en un cierto medio agresivo. Es un
método muy sensible que permite estudiar la probeta incluso en
medios poco conductores. Además, esta técnica nos da
informaciones sobre el mecanismo de corrosión.
1.3.2 Estado de los conocimientos:
descripción de la técnica
Ventajas teóricas: los circuitos
equivalentes
Una ventaja muy importante de EIS sobre otras
técnicas electroquímicas anteriores es que permite la
determinación de un modelo teórico del conjunto
probeta-medio en forma de un circuito electrónico. En efecto, el
gráfico resultante de las mediciones consiste en un barrido en
frecuencia de la impedancia de la probeta. De este gráfico se
puede obtener un circuito equivalente cuyo comportamiento en frecuencia
será lo más cercano al de la probeta. Sin embargo, la
complejidad de los resultados obtenidos dificulta a veces la
interpretación de estos últimos.
Elementos electrónicos utilizados para el
circuito equivalente
Los elementos utilizados son los habituales que
existen en electrónica linear: condensadores C, resistencias R,
e incluso inductancias L. Además de estos se han desarrollado
elementos que no tienen equivalente electrónico pero que
describen fenómenos electroquímicos muy corrientes.
En esta categoría cabe la impedancia de
Warburg, que corresponde a un fenómeno de difusión semi
infinita, es decir a un pequeño agujero en la superficie del
metal, de forma cilíndrica. La difusión es semi infinita
porque se hace desde el seno de la solución hacia la pared del
fondo del cilindro. La hipótesis de difusión semi
infinita es válida cuando (Dox/w)0,5<<dox donde Dox es el
coeficiente de difusión ionico en el óxido en cm2/s, dox
es el espesor de la capa de oxido en nanometros, w la pulsación.
El valor de impedancia correspondiente resulta de la suma de una serie
infinita de grupos electrónicos compuestos de elementos
estándar como resistencias y condensadores.
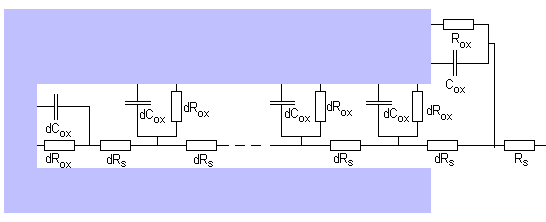
Cada uno de los grupos diferenciales representa los
parámetros de corrosión locales. Rs representa la
resistencia de la solución. El resultado de la suma de todos
estos grupos diferenciales es igual a la impedancia de Warburg, de
formula: W=Z0(jw)-0,5
En el caso en que no se puede considerar la
difusión como semi infinita, es decir, cuando no se respeta la
fórmula (Dox/w)0,5<<dox, se puede utilizar el concepto de
difusión finita. Para eso existen varios métodos
dependiendo del caso concreto al que se aplica.
Para difusión a través de un medio
donde una de las fronteras es bloqueante para las especies en
difusión, la impedancia utilizada suele ser
T=Z0(jw)-0,5xCoth[B(jw)0,5]
Para difusión a través de un medio
donde una de las fronteras, aunque permeable a las especies en
difusión, impone una cierta concentración o actividad
fija, la impedancia utilizada suele ser: O=Z0(jw)-0,5Tanh[B(jw)0,5]. El
parámetro B en los dos casos contiene parámetros
relacionados con el coeficiente de difusión y otros relacionados
al sistema.
En fin destacamos la utilización de un
elemento comodín, creado al origen para modelizar efectos de
superficie y desperfectos en los condensadores, el elemento de fase
constante Q.
La impedancia está afectada de un coeficiente
que modifica el comportamiento.
La formula de esta impedancia es: Q=Z0(jw)-n .
Según los valores de n, Q puede representar: un condensador
(n=1), un Warburg (n=0,5), una resistencia (n=0), y una inductancia (n=
-1). Repórtese también al párrafo " Comportamiento
no ideal, Resistencia de polarización y resistencia de
transferencia de carga, capacidad no ideal" mas abajo en esta
sección
Silverman, "Corrosion rate estimation from
Pseudo-Inductive Electrochemical Impedance Response", Corrosion
Science, Oct 1989, pp824-830
Gayle R., T.Schueller, & S.Ray Taylor,
"Equivalent circuit Modeling of Aluminum/Polymer Laminates using EIS",
in Electrochemical Impedance: Analisis & Interpretation, ASTM STP
1188, Scully & Silverman, Edº Kendigs, ASTM Philadelphia 1993,
pp328-343
Scully, "Characterization of the Corrosión
of Aluminum thin films using EIS methods", ibid., pp276-296
El caso más simple
En el caso de corrosión
más simple se obtiene un comportamiento parecido al del circuito
de Randles. El circuito de Randles consiste en Rs en serie con un
bloque Rp en paralelo con Cdl. Rs representa entonces la resistencia
del electrolito, Rp la resistencia de polarización, Cdl la
capacidad de doble capa.
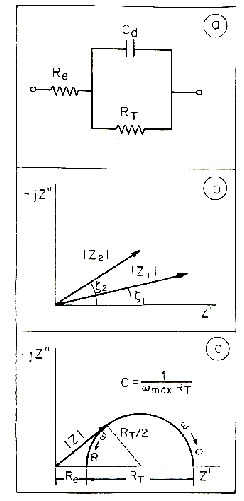
En la figura (a) se ve el circuito de Randles
descrito anteriormente. En la figura (b) está el diagrama de
Argand, en la figura (c) el diagrama de Nyquist correspondiente a un
circuito de Randles con los distintos parámetros del circuito.
Obtención del diagrama
Para obtener una modelización correcta de los
datos medidos, se puede utilizar diagramas lineares, en casos poco
estables. Esto consiste en dibujar los diagramas Z' frente a wZ'' (1) y
Z' frente a Z''/? (2) en el mismo papel. La curva (1) cruza el eje Z'
en Rp+Rs y tiende hacia una recta horizontal de valor Z'=Rs. La curva
(2) cruza el eje Z' en Rs y tiende hacia una recta horizontal de valor
Z'=Rs+Rp. La pendiente de la curva (1) vale - RpC mientras la de la
curva (2) vale 1/RpC. Estos diagramas lineales suelen presentar menos
dispersión que los de Nyquist.
Gráficos obtenidos
Se obtienen los valores del modelo y del
ángulo de fase para cada frecuencia. Con estos datos se pueden
dibujar varios gráficos distintos, siendo cada uno más
adaptado para cierta parte del análisis de resultados.
Es una representación de la evolución
del módulo y del ángulo de fase con la frecuencia.
Permite discriminar mas fácilmente dos constantes de tiempo
próximas.
Es él más utilizado. Consiste en
dibujar la parte imaginaria del modulo, Z'', en función de su
parte real, Z'. La frecuencia no aparece explícitamente. Un caso
simple de corrosión - circuito de Randles- resulta en un
semicírculo centrado en (Rs+½Rp;0) y de radio ½Rp.
Este diagrama consiste en representar la parte real
del modulo en función de ?½. La aparición de una
recta de pendiente ½ indica la presencia de un componente de
Warburg, característico de poros en una capa pasiva y, pues, de
una picadura.
A parte de estos tres diagramas principales, existen
varios otros tipos de representar los datos para hacer aparecer ciertos
valores más fácilmente
"Basics of Electrochemical Impedance
Spectroscopy", Princeton applied research, Application Note AC-1.
Como determinar los parámetros del circuito
Los parámetros del circuito se pueden
determinar mediante análisis del diagrama Z'Z''. Rs se halla a
la intersección del semicírculo y del eje Z', mientras Rp
se determina por diferencia entre el punto de intersección de
baja frecuencia y el de alta frecuencia. C se halla por wmax=1/CRp,
donde wmax es la pulsación en rad.s-1 para el punto mas alto del
semicírculo. También se puede determinar Rp mediante el
ángulo de fase máximo, pero este método es menos
exacto. En este caso se aplica: Rp=2|Z|tan wmax.
Detección de varias constantes de tiempo
En el caso de varias constantes de tiempo, puede
resultar difícil el análisis de una de ellas en el
diagrama de Nyquist. Por ejemplo, si una constante de tiempo es muy
pequeña frente a la otra, puede resultar en un
semicírculo tan pequeño que está completamente
dominado por el otro. En estos casos puede ser útil utilizar un
diagrama de Bode para detectar todas las constantes de tiempo. En este
diagrama, cada nueva constante de tiempo resulta en un pico en el
gráfico de fase.
Comportamiento no ideal, Resistencia de
polarización y resistencia de transferencia de carga, capacidad
no ideal
En realidad se suelen obtener diagramas de Nyquist
que se alejan de este modelo. Un caso frecuente es la aparición
de un fenómeno inductivo en bajas frecuencias que dificulta la
determinación de Rp.
El semicírculo cruza el eje Z' y vuelve hacia
sí mismo en un bucle inductivo, cruzando otra vez el eje Z' para
un valor inferior. ¿Cómo discriminar entre estos dos
valores a la hora de determinar Rp? Se definen dos resistencias
distintas.
La resistencia de polarización es el
límite en bajas frecuencias de Re{Zf} donde Zf es la impedancia
del bucle inductivo y Re{} representa la parte real del argumento.
La resistencia de transferencia de carga se define
como el límite en altas frecuencias de Re{Zf}.
Dicho de otra manera, Rp es la resistencia
límite en bajas frecuencias, mientras Rt es la resistencia
definida por la intersección del semicírculo con el eje
Z' de más alta frecuencia.
Una primera manera de aproximarse al problema
consiste en considerar el efecto inductivo en el modelo
electrónico asociado al sistema. El efecto inductivo resulta en
una impedancia especifica Zf que consta de una resistencia en paralelo
con una inductancia. El diagrama total se descompone en dos
semicírculos con centros en el mismo eje Z'.
Otro método consiste en definir Rt' como el
valor de Resistencia de bajas frecuencias de un semicírculo de
centro ubicado en la zona de Z''<0, por debajo del eje Z', y que
ajuste lo mejor posible con los puntos de medición.
Por otra parte, los semicírculos que se suelen
obtener no son perfectos. Parecen aplastados. Este aspecto se debe
según varios autores a defectos de superficie, que no es
realmente plana sino que tiene defectos en forma fractal (poros,
cambios de planos, acumulación de material...).
Algunos autores han propuesto la utilización
de un elemento electrónico nuevo, el elemento de fase constante
(Constant Phase Element) para modelizar este efecto. La impedancia
está afectada de un coeficiente que modifica el comportamiento.
La formula de esta impedancia es: Q=Z0(jw)-n.
Según los valores de n, Q puede representar: un condensador
(n=1), un Warburg (n=0,5), una resistencia (n=0), y una inductancia (n=
-1).
Mansfeld "Recording and analisis of AC Impedance
Data for Corrosion Studies", Corrosion vol36, nº5, May 1981 p301 y
siguientes.
I.D. Raistrick, C.Ho &R.A. Huggins, "Solid
Stat ionics", Journal of Electrochemical Society, nº123,, 1976,
ref. 1469
Schueller &Taylor, "Equivalent circuit
Modeling of Aluminum/polymer laminates using EIS" in Electrochemicel
impedance: Análisis and Interpretation, ASTM STP1188,Scully,
Silverman & Kendig Eds, American society for testing and materials,
Philadelphia, 1993, pp328-343
Precauciones teóricas
La teoría de análisis de señal
prevé la equivalencia de los dominios temporales y en
frecuencia. Se puede entonces asegurar la unicidad del circuito
equivalente a un espectro determinado sólo si conocemos el
espectro para todas las frecuencias posibles, 0Hz a (Hz. Sin embargo,
hacemos medidas sólo en un rango de frecuencias. El circuito
obtenido no tiene por qué ser el único válido en
este caso.
Limitaciones de la técnica
A pesar de las ventajas de la técnica EIS
sobre otras, no se trata de un método perfecto de
análisis y tiene algunas limitaciones conocidas.
Una limitación bastante importante está
relacionada al tiempo necesario para llevar a cabo un ensayo completo.
El ensayo consiste en un barrido de frecuencias desde frecuencias altas
a frecuencias muy bajas, esperando cada vez la estabilización
del sistema antes de hacer sus medidas. Por consecuencia, las medidas
de frecuencia más baja son mucho más lentas que las de
frecuencia alta y afectan a la duración del ensayo.
Como se ha visto en el párrafo anterior, hay
necesidad de realizar el barrido en el rango de frecuencia lo
más extendido posible para discriminar mejor entre dos circuitos
modelo. Una limitación aparece entonces debida a las diversas
frecuencias de corte del equipo de medida y análisis. Si pasamos
una frecuencia de corte de uno de estos aparatos, el resultado final
está afectado.
Por fin, las altas frecuencias utilizadas a menudo
tienen un efecto no deseado en los mismos hilos que unen las probetas
al equipo de medida. Estos hilos metálicos constituyen una
inductancia parásita que aparece en alta frecuencia.
1.3.3 Resultados teóricos: Modelo de
Mansfeld
Introducción
Algunos autores se han interesado ya a aleaciones MMC
de base aluminio. Este trabajo se basa esencialmente, en cuanto a los
protocolos experimentales y al modelo aplicado, en un trabajo de:
Mansfeld & al., "Detection and Monitoring of
Localized Corrosion by EIS", ASTM STP 1188, Edº Scully, Silvermann
& Kendig, Philadelphia, 1993.
El circuito modelo empleado como base se halla en:
Mansfeld, Lin, Kim, Shih, "A fitting procedure
for impedance spectra obtained for cases of localized corrosion",
Corrosion, Vol 45 nº8, 1989.
A continuación, revisamos los métodos
aplicados y los resultados obtenidos por estos autores.
Descripción del experimento
En su experimento, detallado en el articulo citado
antes, los autores aplican la técnica EIS a aleaciones MMC de
base aluminio 6061 y 7075 con refuerzos de carburo de silicio.
Las probetas difieren en cuanto al estado de
superficie. Algunas son ensayadas en estado de recepción,
lijadas con papel de grano 600, pulidas o pasivadas según varios
procesos. El más destacado de estos es un proceso basado en
inmersiones en soluciones conteniendo Ce seguida por otra en una
solución de Na2MoO4. Este proceso esta referido como el proceso
al CeMo.
Los ensayos consisten en sumergir las probetas en una
solución 0.5mol.l-1 NaCl durante varios días, realizando
ensayos EIS a ciertos intervalos de tiempo.
Los autores describen los siguientes resultados
Mansfeld, Wang, Shih, "The CeMo process for
surface modification of Al Based materials" Proc. 5th Int. fischer
Symp., Karlsruhe, Germany, June91 Electrochem. acta (in press).
Resultados obtenidos por esos autores
Los datos EIS han sido obtenidos a Ecorr como
función del tiempo en un medio de 0.5Mol.l-1 de NaCl. Para
superficies en estado de recepción, modificaciones del espectro
se observan en muy poco tiempo mientras que para superficies pasivadas
no hay cambio en el espectro por mucho mas tiempo. Para 7075 T6 en
estado de recepción, se observan grandes decrementos en la
impedancia en la zona capacitiva del espectro cuando aparecen los
primeros rasgos de picadura. Además, cambia la respuesta a baja
frecuencia para la característica de corrosión por
picadura que es una línea de impedancia o impedancia de Warburg.
Los datos de baja frecuencia presentan a veces un comportamiento
erróneo probablemente debido a cambios en el potencial de
corrosión Ecorr. Estos datos se han eliminado antes de analizar
los resultados. Para Al 6061 en condiciones de recepción y
después de pulido, no se observa el incremento de la capacidad
con el tiempo que existe en el caso de Al 7075 T6 (condiciones de
recepción). Sin embargo, se observa la impedancia de
línea de transmisión en bajas frecuencias después
de un o dos días de exposición. Curvas para Al 6061
tratado con el proceso al CeMo se comporten como superficies pasivas
hasta mucho mas tiempo, incluso después de 30 días. La
resistencia de polarización queda muy elevado con 10e7
ohms.cm². No hay cambios significativos después de 60
días.
Modelo teórico propuesto
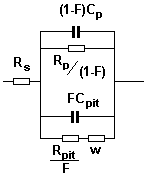 Los datos de impedancia para
probetas sin tratamiento
y con tratamiento después de largos periodos de tiempo se puede
describir mediante el circuito equivalente de la figura. Mas
informaciones acerca de este modelo y del programa utilizado para el
análisis de resultados se pueden hallar en:
Los datos de impedancia para
probetas sin tratamiento
y con tratamiento después de largos periodos de tiempo se puede
describir mediante el circuito equivalente de la figura. Mas
informaciones acerca de este modelo y del programa utilizado para el
análisis de resultados se pueden hallar en:
Mansfeld,
Shih, "detection and Monitoring of localized corrosion of Al alloys
with EIS", proc. Int. Symp. on "corrosion testing of Al alloys", ASTM
STP 1134 1992.
Rp y Cp son las resistencias de polarización y
capacidad de la superficie pasiva. Rpit y Cpit son, los
parámetros correspondientes para la picadura. La respuesta en
baja frecuencias está descrita por W=(K/F)(j?)n, impedancia de
Warburg. K y n son parámetros experimentales. F es el porcentaje
de área picada (0<F<1). Rs es la resistencia del
electrolito no compensada. El espectro teórico para F=0 y
F=0.005 enseña la sensibilidad del espectro a la
aparición de picaduras. Las modificaciones se observan en bajas
frecuencias con aparición de la impedancia de Warburg, y en la
zona capacitiva con el decremento de la impedancia. Se observa,
además, que la presencia de la impedancia de Warburg en bajas
frecuencias tiene consecuencias en el ángulo de fase que pasa de
0 a 20 a f=1mHz, característico de una nueva constante de
tiempo. Se han observados espectros similares al obtenido para F=0 en
probetas expuestas a NaCl sin corroer y también otros similares
al obtenido en el caso F=0.005 para aleaciones de Al a potencial mayor
que Epit.
Análisis de los datos recogidos
El análisis de los resultados de EIS resulta
en los parámetros Rs, Rp/(1-F), Ct=Cp(1-F)+FCpit; Rpit/F; F/F; y
n. como F es habitualmente muy pequeño, Rp/(1-F)=Rp y Ct=
Cp+FCpit. Como consecuencia de esta última fórmula, se
detecta la aparición de Cpit cuando aumenta la capacidad total
Ct. Esta capacidad total aumenta ya en los dos primeros días
para el Al 7075 T6 en estado de recepción mientras que el
pasivado permanece sin aumentar hasta varios días más,
cuando se inician las picaduras. Para el aluminio Al 6061T6 pulido el
incremento es muy pequeño y Ct aumenta significativamente para
el Al 6061 en estado de recepción sólo después de
7 días de exposición. Rpit/F y K/F tienen comportamientos
distintos según los materiales. n permanece constante alrededor
de 0.8 para probetas pulidas o en estado de recepción.
Las impedancias especificas R0p y R0pit, C0p y C0pit
se pueden determinar sólo si se conoce la evolución de F
con el tiempo. Esta se halla estudiando la probeta con un microscopio.
Estimación de la velocidad de crecimiento
de picaduras
El valor de F ha sido determinado visualmente al
final del experimento. Además, FCpit ha sido evaluado por FCpit
= Ct-Cp, suponiendo que Cp no ha cambiado entre el inicio de picaduras
y el final del experimento, ya que no cambiaba entre el inicio del
experimento y el inicio de picaduras. Basándose en un valor
constante de C0pit es posible determinar el valor de F con el tiempo.
R0pit esta determinado por R0pit=Rpit*2FA; siendo A el área
hemisférica de la picadura. También se determina
así K0.
Caso de Al 7075 T6, tratado con el proceso al CeMo
R0pit aumenta de manera continua con el tiempo
indicando un descenso en la velocidad de crecimiento de la picadura.
R0p aumenta ligeramente con el tiempo, indicando un aumento de la
velocidad de corrosión de la superficie pasiva con el tiempo. Se
nota que, cuando aparecen las primeras picaduras, Rp aumenta mucho,
actuando la picadura como protección anódica de la
demás superficie. El parámetro K0 también aumenta
con el tiempo.
Caso de Al 6061
F aumenta con el tiempo. K0 aumenta bastante para
todos los tipos de superficie. R0p y R0pit aumentan, señalando
un descenso de la velocidad de corrosión.
Tamaño mínimo de picadura detectable
Se ha determinado el tamaño mínimo
teóricamente detectable mediante EIS. Se supone que crece una
picadura de A=1cm² en una superficie pasiva. El radio r de la
picadura pasa de 0 a 0.05 cm mientras F pasa de 0 a 0.016. El espectro
cambia de manera característica para r=0.015cm, o sea, F=0.0015.
Conclusión
El trabajo de estos autores parece utilizable en el
diseño de nuestro propio experimento. Hemos utilizado el
protocolo experimental descrito como base a la hora de diseñar
nuestro experimento. La determinación de la velocidad de
picadura parece muy dependiente de la manera de estimar el área
picada. Como esta última se determina por observación
micrográfica, según los mismos autores, parece
difícil alcanzar un alto grado de reproductibilidad y confianza
en este dato.
1.3.4 Otros resultados teóricos sobre
aluminio anodizado
Introducción
El aluminio es un metal de particular interés
y muchos equipos de investigación lo han estudiando. Una
aplicación del aluminio necesita su protección por
anodización. El proceso de anodización y el posterior
sellado se pueden estudiar mediante EIS. Especial atención se
presta al proceso de sellado de poros en la capa pasiva de
óxidos. El objetivo suele ser entonces la detección de
poros mal sellados en un medio poco agresivo.
Aunque no se puedan comparar directamente los
resultados, puede resultar interesante comparar los fenómenos
que son descritos. En efecto, los materiales basado en aluminio aleado
no suelen tener la misma composición y tampoco están
reforzados con cerámicos o fabricados por el mismo proceso.
Modelos para el aluminio anodizado
Varios modelos han sido propuestos para describir el
comportamiento de las capas de protección del aluminio durante
los ensayos EIS. Uno de los mas antiguos modelos propuesto no utiliza
una impedancia de Warburg para modelizar los poros sino que consta de
un bloque compuesto de una resistencia en paralelo R2 con un
condensador C2 en su sitio. Esta resistencia representa la resistencia
de la capa de óxidos que protege el metal (capa de base)
mientras el condensador figura la capacidad asociada. Este modelo no
permite representar un ataque corrosivo porque supone que siempre
existe una capa de óxidos de base que protege al metal.
J.P. Hoar & G.C. Wood, Electrochemical Acta
7, 333, año 1962
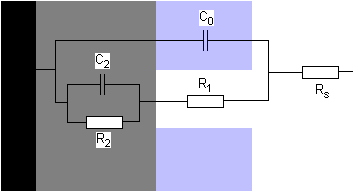
Otros autores (Lorenz & al.) han sugerido un
modelo doble, según la picadura esté activa o no. Cuando
no lo es, el modelo está próximo al descrito por
Mansfeld. Se modeliza la doble capa en dos bloques RC en paralelo,
afectados por un coeficiente (1-F) donde F representa la
fracción de área que está ocupada por picaduras.
Los puntos (poros) donde no existe la capa porosa exterior de
óxidos pero sí la capa protectora interior, está
modelizado por un grupo RC en paralelo, afectado por el coeficiente F.
Al contrario del modelo de Mansfeld, este modelo no precisa un
cálculo de elementos equivalentes a varios elementos
electrónicos del circuito antes de utilizar métodos
matemáticos de aproximación a los valores del circuito.
Este modelo de picadura pasiva se caracteriza por
presentar dos constantes de tiempo, en altas y bajas frecuencias, y por
enseñar el desplazamiento de la constante de altas frecuencias
hacia la zona de bajas frecuencias, cuando aumenta el número de
picaduras, por aumentar la capacidad total medida asociada.
 Los
iones oxidantes se hidratan y se rodean de una capa de moléculas
de
agua con enlaces fuertes. Al acercarse de la superficie del metal,
estas moléculas de agua, como las que están adsorbidas en
la
superficie, impiden en contacto entre los iones oxidantes y el metal en
estado metálico. La energía necesaria para romper los
enlaces con las
moléculas de está capa constituye la energía de
activación. La
existencia de esta barrera de energía puede ralentizar
considerablemente el proceso de corrosión. El plano de Helmholtz
es el
plano paralelo a la superficie de la probeta y alejado de la distancia
mínima de acercamiento de los iones sin que tengan que
deshacerse de su
capa de hidratación.
Los
iones oxidantes se hidratan y se rodean de una capa de moléculas
de
agua con enlaces fuertes. Al acercarse de la superficie del metal,
estas moléculas de agua, como las que están adsorbidas en
la
superficie, impiden en contacto entre los iones oxidantes y el metal en
estado metálico. La energía necesaria para romper los
enlaces con las
moléculas de está capa constituye la energía de
activación. La
existencia de esta barrera de energía puede ralentizar
considerablemente el proceso de corrosión. El plano de Helmholtz
es el
plano paralelo a la superficie de la probeta y alejado de la distancia
mínima de acercamiento de los iones sin que tengan que
deshacerse de su
capa de hidratación. El potencial del aluminio 6061
en sus dos estados de temple T4 y T6 es de -0.80V para el primero y
-0.83V para el segundo, o sea, bastante reactivo.
El potencial del aluminio 6061
en sus dos estados de temple T4 y T6 es de -0.80V para el primero y
-0.83V para el segundo, o sea, bastante reactivo.


 Los datos de impedancia para
probetas sin tratamiento
y con tratamiento después de largos periodos de tiempo se puede
describir mediante el circuito equivalente de la figura. Mas
informaciones acerca de este modelo y del programa utilizado para el
análisis de resultados se pueden hallar en:
Los datos de impedancia para
probetas sin tratamiento
y con tratamiento después de largos periodos de tiempo se puede
describir mediante el circuito equivalente de la figura. Mas
informaciones acerca de este modelo y del programa utilizado para el
análisis de resultados se pueden hallar en: